学术动态 | 清华大学/天坛神外在Nature子刊报道弥漫内生型脑桥胶质瘤研究新进展 筛选出小分子抑制剂ABBV-075
学术动态
神外前沿

神外前沿讯,4月17日,Nature Communications杂志(中科院1区Top,IF=14.7)在线发表了清华大学生命学院 郗乔然课题组与首都医科大学附属天坛医院 张力伟课题组题为 “An oncohistone-driven H3.3K27M/CREB5/ID1 axis maintains the stemness and malignancy of diffuse intrinsic pontine glioma”的研究成果。
作者团队
Wei Zhou, Cheng Xu, Shuangrui Yang, Haocheng Li, Changcun Pan, Zhuang Jiang, Luyang Xie, Xiaohan Li, Huimin Qiao, Da Mi, Yujie Tang, Liwei Zhang(张力伟), Qiaoran Xi
据了解,弥漫内生型脑桥胶质瘤(DIPG) 是一种高度致命的儿童脑瘤,由于肿瘤位于“手术禁区”——脑干,手术切除几乎不可能。至今已有超过300项药物治疗的临床试验失败,目前仅有放疗可暂时缓解病情,但只能延长生存期2至3个月。患者从确诊到死亡通常不超过一年,两年生存率不足10%,五年生存率低于1%,是所有癌症中最具致死性的肿瘤之一。
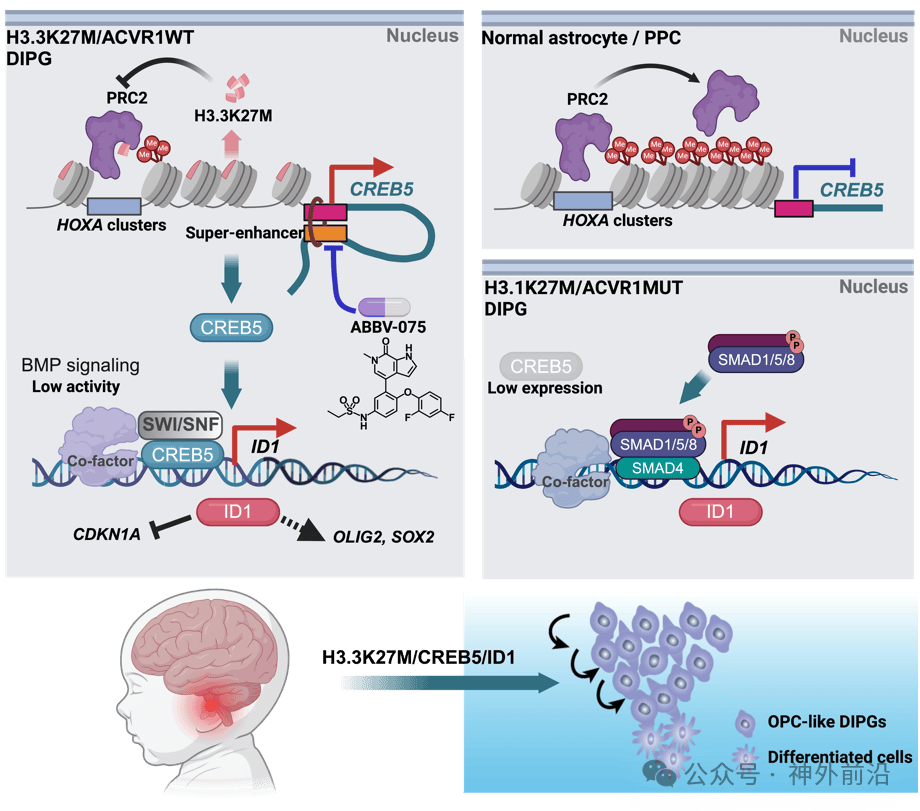
本项研究系统性阐释了癌组蛋白H3.3K27M通过重塑表观遗传景观激活致癌转录因子CREB5,进而维持DIPG的干性和恶性细胞状态,促进肿瘤发生发展。并提出了靶向CREB5超级增强子的表观遗传治疗策略,为DIPG治疗提供了潜在方案。
论文链接/引用信息
研究团队此前的研究表明,在H3.3K27M亚型的DIPG中,BMP信号通路处于低活性状态。而本研究中,研究团队还发现该通路的下游靶基因ID1仍高度表达。进一步实验证实,ID1作为致癌干性因子,可维持H3.3K27M亚型DIPG的干性和恶性特征。 还证明了癌组蛋白H3.3K27M能够通过重塑CREB5基因区域的H3K27me3的水平,从而激活CREB5的表达。
在药物层面,研究团队 筛选出小分子抑制剂ABBV-075,可抑制CREB5超级增强子活性,从而降低CREB5表达、抑制肿瘤生长。联合使用ABBV-075与BRG1抑制剂,产生更显著的协同抑制效果,为DIPG的治疗提供了新的方向。
神外前沿-中国神经外科新媒体;投稿邮箱:shenwaiqianyan@qq.com(恕不接收一稿多投,投稿后作者不可审改稿,神外前沿自行修改并择期发布);任何媒体、网站等机构如需转载或引用,须获得书面授权。









评论